- 技术(专利)类型 发明专利
- 申请号/专利号 201710092816.5
- 技术(专利)名称 一种双重修饰聚氰基丙烯酸正丁酯纳米粒、其制备方法及用途
- 项目单位 宣武医院
- 发明人 张兰 胡晓 李林
- 行业类别 人类生活必需品
- 技术成熟度 正在研发
- 交易价格 ¥面议
- 联系人 王丽霞
- 发布时间 2021-09-01
 北京
北京
客服热线:010-83278899
 微信公众号 扫一扫 关注我们
微信公众号 扫一扫 关注我们

项目简介
本发明涉及一种双重修饰聚氰基丙烯酸正丁酯纳米粒,含有所述纳米粒的载药体系,所述纳米粒用于制备载药体系的用途,以及制备所述纳米粒和载药体系的方法。本发明还涉及含有所述载药体系的药物组合物,以及所述纳米粒或载药体系在制备药物组合物中的用途,所述药物组合物用于诊断、预防和/或治疗受试者的中枢神经系统疾病。
说明书
技术领域
本发明涉及一种双重修饰聚氰基丙烯酸正丁酯纳米粒,含有所述纳米粒的载药体系,所述纳米粒用于制备载药体系的用途,以及制备所述纳米粒和载药体系的方法。本发明还涉及含有所述载药体系的药物组合物,以及所述纳米粒或载药体系在制备药物组合物中的用途,所述药物组合物用于诊断、预防和/或治疗受试者的中枢神经系统疾病。
背景技术
目前,中枢神经系统疾病的发病率逐年增高,已经成为影响人口健康水平和生活质量的重大社会问题。血脑屏障(blood-brain barrier,BBB)通透性差是用于诊断或治疗中枢神经系统疾病药物存在的重要问题之一。大部分上述药物在全身给药后,难以透过BBB达到脑内有效治疗浓度,影响了药物的诊断或治疗效果。如何提高药物的BBB通透性,同时确保其在体内的安全有效,是目前急需解决的问题。BBB主要由脑毛细血管内皮细胞紧密结合而成,是存在于血液和中枢神经系统之间的屏障结构。一方面,BBB起到保护神经的作用,能够保证中枢神经系统较少被外来物质侵扰;然而,BBB的致密结构也阻碍了用于诊断或治疗脑部疾病的药物通过非侵入性的给药方式进入脑内,限制了药物对脑内疾病的有效诊断或治疗。据报道,100%的大分子药物和98%的小分子药物都难以透过BBB到达脑组织。聚氰基丙烯酸正丁酯(PBCA)纳米粒具有良好的降解性和生物相容性,无免疫原性,可以运载不同的药物。但是,普通PBCA纳米粒的BBB通透性并不显著。有文献报道,将表面活性剂Tween-80修饰在PBCA纳米粒表面,以增加PBCA纳米粒的BBB通透性。但是,这种方法存在以下弊端:在药物安全性方面,Tween-80静脉给药后可能引起溶血;利用Tween-80提高纳米粒的BBB通透性,可能造成脑内Tween-80的暴露量增加,从而引起毒性;此外,Tween-80单独修饰的纳米粒经静脉给药后,在体内容易被网状内皮系统的巨噬细胞识别吞噬,造成纳米粒的体内循环时间过短,脑靶向效果不理想。聚乙二醇(PEG)是目前国内外应用最为广泛的纳米粒表面修饰材料,其能够阻止蛋白质的吸附,同时使纳米粒躲避网状内皮系统的捕捉,从而延长纳米粒在体内的循环时间,提高纳米粒的缓释性。但是,PEG具有较强的亲水性,单独用其对纳米粒进行修饰,不利于纳米粒透过脂类性质的血脑屏障,使得纳米粒在体内的脑靶向性较差,BBB通透性不明显,无法作为良好的脑靶向性载体使用。因此,本领域需要开发具有更高BBB通透性、更加安全、并具有良好缓释性的药物载体,用于中枢神经系统疾病的诊断、预防和/或治疗。
发明内容
在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所涉及的实验室操作步骤均为相应领域内广泛使用的常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。如本文中使用的,术语“聚氰基丙烯酸正丁酯”是指以氰基丙烯酸正丁酯为单体,经过聚合反应得到的聚合物,所述氰基丙烯酸正丁酯具有如下结构: 如本文中使用的,术语“纳米粒”是指粒径在纳米级的粒子,例如粒径不大于1000nm粒子,例如粒径在50~800nm之间的粒子。如本文中使用的,术语“粒径”即“等效粒径”,是指当被测粒子的某种物理特性或物理行为与某一直径的同质球体(或组合)最相近时,就把该球体的直径(或组合)作为被测粒子的等效粒径(或粒度分布)。如本文中使用的,术语“平均粒径”是指对于一个由大小和形状不相同的粒子组成的实际粒子群,与一个由均一的球形粒子组成的假想粒子群相比,如果两者的粒径全长相同,则称此球形粒子的直径为实际粒子群的平均粒径。平均粒径的测量方法是本领域技术人员已知的,例如光散射法;平均粒径的测量仪器包括但不限于光散射粒度仪。如本文中使用的,术语“乳化聚合”是指单体在介质中分散成乳液状态下发生的聚合。通常,单体在机械搅拌和稳定剂的作用下分散成单体液滴,并通过聚合反应形成聚合物粒子,所述聚合物粒子的粒径可以是微米级或纳米级。例如,本发明中,氰基丙烯酸正丁酯可以在酸性介质(例如盐酸溶液)中,通过乳化聚合形成聚氰基丙烯酸酯纳米粒。可以通过在聚合反应体系中加入修饰物,得到表面带有修饰物的聚合物粒子。如本文中使用的,术语“稳定剂”是指能够保持或增强粒子的稳定性的物质。在乳化聚合中,稳定剂可以在单体液滴或聚合物粒子表面形成保护层,防止凝聚,使乳液稳定。所述稳定剂包括但不限于环糊精(例如Dex70)、聚乙烯吡咯烷酮(例如PVP-K30)和泊洛沙姆(例如泊洛沙姆F68)。如本文中使用的,术语“亲水性聚合物”是指带有极性基团、对水有大的亲和力的聚合物,其可以吸引水分子和/或溶解于水。所述亲水性聚合物包括可以在水中溶解或溶胀的聚合物,例如聚乙二醇、聚丙烯酰胺、聚乙烯吡咯烷酮、聚乙烯醇和羧甲基纤维素。如本文中使用的,术语“脂类”是指不溶于水但能溶于非极性有机溶剂(例如氯仿、乙醚、丙酮或苯等)的有机化合物,例如磷脂(例如甘油磷酸脂和鞘磷脂)和固醇。如本文中使用的,术语“甘油磷酸脂”是指具有如下结构的一类化合物:
其中,R1和R2为脂肪酸的碳氢链,X为氢或极性取代基。所述甘油磷酸酯包括但不限于卵磷脂(磷脂酰胆碱)、脑磷脂(磷脂酰乙醇胺)、磷脂酰丝氨酸和磷脂酰肌醇。如本文中使用的,术语“卵磷脂”是指甘油磷酸酯中,X为-CH2CH2N+(CH3)3的实例,并且R1通常为饱和碳氢链(例如含有16-18个碳原子的饱和碳氢链),R2通常为不饱和碳氢链,例如花生四烯酸的碳氢链(CH3(CH2)4(CH=CH-CH2)4(CH2)2-)。如本文中使用的,术语“固醇”又称甾醇,是指以环戊烷多氢菲为基本结构,并含有醇羟基的化合物,包括但不限于动物性固醇(例如胆固醇)、植物性固醇和菌类固醇。如本文中使用的,术语“胆固醇”是指具有如下结构的化合物:
如本文中使用的,术语“氨基酸”是指含有氨基的羧酸,包括但不限于:脂肪族氨基酸,例如丙氨酸、亮氨酸、缬氨酸和天冬氨酸;芳香族氨基酸,例如苯丙氨酸和酪氨酸;杂环氨基酸,例如组氨酸和色氨酸;以及杂环亚氨基酸,例如脯氨酸。如本文中使用的,术语“聚乙二醇(PEG)”是指以-CH2CH2O-为重复单元的聚合物,其数均分子质量为200以上,例如200~20000。所述聚乙二醇分子链的两个端基可以均为羟基,或者一个端基为羟基,另一个端基为甲氧基(即甲氧基聚乙二醇,mPEG)。数均分子量为100000~1000000的聚乙二醇又被称为聚氧化乙烯(PEO)。本发明中,聚乙二醇和聚氧化乙烯具有相同的含义。如本文中使用的,术语“聚乙烯醇(PVA)”是指以-CH2CH(OH)-为重复单元的聚合物。如本文中使用的,术语“聚乙烯吡咯烷酮(PVP)”是指具有如下重复单元的聚合物:
如本文中使用的,术语“香豆素-6”是指具有如下结构的化合物:
如本文中使用的,术语“包封率”用来表征载药体系对药物的包封程度。本发明中,包封率的计算公式为:包封在纳米粒中的药物的量/(包封在纳米粒中的药物的量+未包封在纳米粒中的药物的量)×100%。如本文中使用的,术语“载药量”用来表征载药体系中含有的药物量,本发明中,载药量的计算公式为:载药纳米粒中药物的质量/(载药纳米粒中药物的质量+载药纳米粒的质量)×100%。如本文中使用的,术语“室温”是指25±5℃。如本文中使用的,术语“约”应该被本领域技术人员理解,并将随其所用之处的上下文而有一定程度的变化。如果根据术语应用的上下文,对于本领域技术人员而言,其使用不是清楚的,那么“约”的意思是不超过所述特定数值或范围的正负10%。本发明人通过深入的研究和创造性的劳动,得到了双重修饰的聚氰基丙烯酸正丁酯纳米粒,以及含有所述纳米粒的载药体系。所述纳米粒可用作药物的脑靶向递送载体,具有良好的安全性、缓释性和BBB通透性,可以有效提高药物进入脑内的浓度,并使药物缓慢释放,延长其体内循环时间,由此提供了下述发明:在一个方面,本发明提供了一种纳米粒,其包含聚氰基丙烯酸正丁酯,或主要由聚氰基丙烯酸正丁酯构成,所述纳米粒表面修饰有第一修饰物和第二修饰物,所述第一修饰物为亲水性聚合物,所述第二修饰物为氨基酸和/或脂类。在一个优选的实施方案中,所述氨基酸为L-氨基酸。在一个优选的实施方案中,所述氨基酸为天冬氨酸和亮氨酸。在一个优选的实施方案中,所述脂类选自磷脂(例如卵磷脂)和固醇(例如胆固醇)。在本发明中,优选地,所述氨基酸和脂类是天然存在于受试者(例如哺乳动物;例如牛科动物、马科动物、羊科动物、猪科动物、犬科动物、猫科动物、啮齿类动物、灵长类动物;例如,人)体内的氨基酸和脂类。但是,本发明不限制所述氨基酸和脂类的来源,其可以从受试者体内提取得到,或者可以通过人工合成得到。在一个优选的实施方案中,所述亲水性聚合物选自聚乙二醇、聚乙烯醇和聚乙烯吡咯烷酮,优选为聚乙二醇。在一个优选的实施方案中,所述亲水性聚合物的数均分子质量为2000~20000,例如2000~5000、5000~10000、10000~15000或15000~20000,例如2000、5000、10000、15000或20000。在一个优选的实施方案中,所述纳米粒的平均粒径为50~800nm,例如50~100nm、100~400nm、400~600nm或600~800nm。在一个优选的实施方案中,所述纳米粒的多分散指数(PDI)为0.100~0.300,例如0.100~0.200或0.200~0.300。在一个优选的实施方案中,所述纳米粒的Zeta电位为-100~0mV,例如-100~-70mV、-80~-40mV、-60~-10mV或-40~0mV。在一个优选的实施方案中,所述第一修饰物与聚氰基丙烯酸酯的质量比为0.5%~5%,例如0.5%~1%、1%~2%、2%~3%、3%~4%或4%~5%。在一个优选的实施方案中,所述第二修饰物与聚氰基丙烯酸酯的质量比为0.05%~2%,例如0.05%~0.1%、0.1%~0.5%、0.5%~1%、1%~1.5%或1.5%~2%。在一个优选的实施方案中,所述纳米粒表面的第二修饰物的浓度为5×10-7ng/纳米粒~1×10-6ng/纳米粒,例如5×10-7ng/纳米粒~6×10-7ng/纳米粒、6×10-7ng/纳米粒~7×10-7ng/纳米粒、7×10-7ng/纳米粒~8×10-7ng/纳米粒、8×10-7ng/纳米粒~9×10-7ng/纳米粒或9×10-7ng/纳米粒~1×10-6ng/纳米粒。在一个优选的实施方案中,所述纳米粒包含聚氰基丙烯酸正丁酯,或主要由聚氰基丙烯酸正丁酯构成,所述纳米粒表面修饰有第一修饰物和第二修饰物,所述第一修饰物为聚乙二醇,所述第二修饰物选自卵磷脂、胆固醇、天冬氨酸和亮氨酸。在一个优选的实施方案中,所述聚乙二醇的数均分子量为10000~20000。在一个优选的实施方案中,所述纳米粒的平均粒径为100~400nm。在一个优选的实施方案中,所述纳米粒的Zeta电位为-40~0mV。任选地,本发明的纳米粒还含有稳定剂,例如,所述稳定剂选自环糊精(例如Dex70)、聚乙烯吡咯烷酮(例如PVP-K30)和泊洛沙姆(例如泊洛沙姆F68)。在一个优选的实施方案中,所述纳米粒由包含以下步骤的方法制得:步骤1:使氰基丙烯酸正丁酯单体在酸性介质中发生聚合反应,所述酸性介质中含有第一修饰物;优选地,所述酸性介质中还含有稳定剂;步骤2:向步骤1的反应混合物中加入碱至反应混合物呈中性,过滤,对滤液进行冷冻干燥;步骤3:将冷冻干燥的产物分散于缓冲溶液中,加入第二修饰物进行孵育;步骤4:从步骤3的混合物中分离出纳米粒;优选地,所述分离包括过滤和/或冷冻干燥。在一个优选的实施方案中,在步骤1中,所述氰基丙烯酸正丁酯单体与酸性介质的质量/体积比为0.05%~1%g/ml,例如0.05%~0.1%g/ml、0.1%~0.5%g/ml、0.1%-0.75%g/ml或0.75%~1%g/ml。在一个优选的实施方案中,在步骤1中,所述第一修饰物与酸性介质的质量/体积比为0.5%-5%g/ml,例如0.5%~1%g/ml、0.5%~2%g/ml、1%~3%g/ml或3%~5%g/ml。在一个优选的实施方案中,在步骤1中,所述稳定剂与酸性介质的质量/体积比为0.05%~5%g/ml,例如0.5%~1%g/ml、0.5%~2%g/ml、1%~3%g/ml或3%~5%g/ml。在一个优选的实施方案中,在步骤1中,所述稳定剂选自环糊精(例如Dex70)、聚乙烯吡咯烷酮(例如PVP-K30)和泊洛沙姆(例如泊洛沙姆F68)。在一个优选的实施方案中,所述酸性介质为盐酸溶液;优选地,所述盐酸溶液的pH为1.0~3.0。在一个优选的实施方案中,所述聚合反应在室温下进行。在一个优选的实施方案中,步骤1的聚合反应进行1~10小时、例如1~5小时、2~6小时、3~7小时、4~8小时或5~10小时。在一个优选的实施方案中,步骤2中,所述碱为氢氧化钠。在一个优选的实施方案中,步骤2中,使用滤膜进行过滤,优选地,使用孔径为0.45μm的滤膜进行过滤。在一个优选的实施方案中,步骤3中,所述缓冲溶液为磷酸缓冲溶液。在一个优选的实施方案中,在步骤3中,所述第二修饰物与缓冲溶液的质量/体积比为0.05%~2%g/ml,例如0.05%~0.1%g/ml、0.1%~0.5%g/ml、0.5%~1%g/ml或1%~2%。在一个优选的实施方案中,步骤3中,孵育的时间为0.5~5小时,例如0.5~1小时、1~2小时、2~3小时、3~4小时或4~5小时。在一个方面,本发明提供了制备如上所述的纳米粒的方法,其包含以下步骤:步骤1:使氰基丙烯酸正丁酯单体在酸性介质中发生聚合反应,所述酸性介质中含有第一修饰物;优选地,所述酸性介质中还含有稳定剂;步骤2:向步骤1的反应混合物中加入碱至反应混合物呈中性,过滤,对滤液进行冷冻干燥;步骤3:将冷冻干燥的产物分散于缓冲溶液中,加入第二修饰物进行孵育;步骤4:从步骤3的混合物中分离出纳米粒;优选地,所述分离包括过滤和/或冷冻干燥。在一个优选的实施方案中,在步骤1中,所述氰基丙烯酸正丁酯单体与酸性介质的质量/体积比为0.05%~1%g/ml,例如0.05%~0.1%g/ml、0.1%~0.5%g/ml、0.1%-0.75%g/ml或0.75%~1%g/ml。在一个优选的实施方案中,在步骤1中,所述第一修饰物与酸性介质的质量/体积比为0.5%-5%g/ml,例如0.5%~1%g/ml、0.5%~2%g/ml、1%~3%g/ml或3%~5%g/ml。在一个优选的实施方案中,在步骤1中,所述稳定剂与酸性介质的质量/体积比为0.05%~5%g/ml,例如0.5%~1%g/ml、0.5%~2%g/ml、1%~3%g/ml或3%~5%g/ml。在一个优选的实施方案中,在步骤1中,所述稳定剂选自环糊精(例如Dex70)、聚乙烯吡咯烷酮(例如PVP-K30)和泊洛沙姆(例如泊洛沙姆F68)。在一个优选的实施方案中,所述酸性介质为盐酸溶液;优选地,所述盐酸溶液的pH为1.0~3.0。在一个优选的实施方案中,所述聚合反应在室温下进行。在一个优选的实施方案中,步骤1的聚合反应进行1~10小时、例如1~5小时、2~6小时、3~7小时、4~8小时或5~10小时。在一个优选的实施方案中,步骤2中,所述碱为氢氧化钠。在一个优选的实施方案中,步骤2中,使用滤膜进行过滤,优选地,使用孔径为0.45μm的滤膜进行过滤。在一个优选的实施方案中,步骤3中,所述缓冲溶液为磷酸缓冲溶液。在一个优选的实施方案中,在步骤3中,所述第二修饰物与缓冲溶液的质量体积比为0.05%~2%g/ml,例如0.05%~0.1%g/ml、0.1%~0.5%g/ml、0.5%~1%g/ml或1%~2%。在一个优选的实施方案中,步骤3中,孵育的时间为0.5~5小时,例如0.5~1小时、1~2小时、2~3小时、3~4小时或4~5小时。本发明的纳米粒的表面被两种修饰物所修饰,任选地,所述修饰物的分子与聚氰基丙烯酸正丁酯的分子链相互缠结,从而固定在纳米粒表面;或者通过例如氢键、分子间作用力或疏水作用吸附在纳米粒表面;或者通过化学键连接在纳米粒表面。本发明的纳米粒可以用于负载药物,以提高药物的BBB通透性,并使药物具有缓释性。所述药物可以包裹于纳米粒的内部,或者通过化学键连接于纳米粒的表面。优选地,所述药物包裹于纳米粒的内部,以保证药物被稳定、有效地递送。因此,在另一个方面,本发明提供了一种载药体系,其含有如上所述的纳米粒,所述纳米粒负载有药物。在一个优选的实施方案中,所述药物用于诊断、预防和/或治疗受试者的中枢神经系统疾病。在一个优选的实施方案中,所述药物为紫杉醇类药物(例如紫杉醇、多西紫杉醇、卡巴他赛或莱龙泰素,优选为多西紫杉醇)。在一个优选的实施方案中,所述药物为荧光物质(例如香豆素及其衍生物,例如香豆素-6)。在一个优选的实施方案中,所述药物包裹于所述纳米粒中。在一个优选的实施方案中,所述载药体系中,纳米粒对药物的包封率为80%~100%,例如80%~85%、85%~90%、90%~95%或95%~100%。在一个优选的实施方案中,所述载药体系的载药量为1%~10%,例如1%~3%、3%~5%、5%~7%或7%~10%。在一个优选的实施方案中,所述载药体系由包含以下步骤的方法制得:步骤1:使氰基丙烯酸正丁酯单体在酸性介质中发生聚合反应,所述酸性介质中含有第一修饰物;优选地,所述酸性介质中还含有稳定剂;步骤2:向反应混合物中加入药物,之后继续进行聚合反应;步骤3:向反应混合物中加入碱至反应混合物呈中性,过滤,对滤液进行冷冻干燥;步骤4:将冷冻干燥的产物分散于缓冲溶液中,加入第二修饰物进行孵育;步骤5:从步骤4的混合物中分离出纳米粒;优选地,所述分离包括过滤和/或冷冻干燥。在一个优选的实施方案中,在步骤1中,所述氰基丙烯酸正丁酯单体与酸性介质的质量/体积比为0.05%~1%g/ml,例如0.05%~0.1%g/ml、0.1%~0.5%g/ml、0.1%-0.75%g/ml或0.75%~1%g/ml。在一个优选的实施方案中,在步骤1中,所述第一修饰物与酸性介质的质量/体积比为0.5%-5%g/ml,例如0.5%~1%g/ml、0.5%~2%g/ml、1%~3%g/ml或3%~5%g/ml。在一个优选的实施方案中,在步骤1中,所述稳定剂与酸性介质的质量/体积比为0.05%~5%g/ml,例如0.5%~1%g/ml、0.5%~2%g/ml、1%~3%g/ml或3%~5%g/ml。在一个优选的实施方案中,在步骤1中,所述稳定剂选自环糊精(例如Dex70)、聚乙烯吡咯烷酮(例如PVP-K30)和泊洛沙姆(例如泊洛沙姆F68)。在一个优选的实施方案中,所述酸性介质为盐酸溶液;优选地,所述盐酸溶液的pH为1.0~3.0。在一个优选的实施方案中,所述聚合反应在室温下进行。在一个优选的实施方案中,步骤1的聚合反应进行1~10小时、例如1~5小时、2~6小时、3~7小时、4~8小时或5~10小时。在一个优选的实施方案中,所述药物与氰基丙烯酸酯单体的质量比为1~20:1、例如1~5:1、3~10:1、5~15:1或15~20:1。在一个优选的实施方案中,步骤2中在加入药物之后,聚合反应进行0.5~5小时,例如0.5~1小时、1~2小时、2~3小时、3~4小时或4~5小时。在一个优选的实施方案中,步骤3中,所述碱为氢氧化钠。在一个优选的实施方案中,步骤3中,使用滤膜进行过滤,优选地,使用孔径为0.45μm的滤膜进行过滤。在一个优选的实施方案中,步骤4中,所述缓冲溶液为磷酸缓冲溶液。在一个优选的实施方案中,在步骤4中,所述第二修饰物与缓冲溶液的质量体积比为0.05%~2%g/ml,例如0.05%~0.1%g/ml、0.1%~0.5%g/ml、0.5%~1%g/ml或1%~2%。在一个优选的实施方案中,步骤4中,孵育的时间为0.5~5小时,例如0.5~1小时、1~2小时、2~3小时、3~4小时或4~5小时。在另一个方面,本发明提供了制备如上所述的载药体系的方法,其包含以下步骤:步骤1:使氰基丙烯酸正丁酯单体在酸性介质中发生聚合反应,所述酸性介质中含有第一修饰物;优选地,所述酸性介质中还含有稳定剂;步骤2:向反应混合物中加入药物,之后继续进行聚合反应;步骤3:向反应混合物中加入碱至反应混合物呈中性,过滤,对滤液进行冷冻干燥;步骤4:将冷冻干燥的产物分散于缓冲溶液中,加入第二修饰物进行孵育;步骤5:从步骤4的混合物中分离出纳米粒;优选地,所述分离包括过滤和/或冷冻干燥。在一个优选的实施方案中,在步骤1中,所述氰基丙烯酸正丁酯单体与酸性介质的质量/体积比为0.05%~1%g/ml,例如0.05%~0.1%g/ml、0.1%~0.5%g/ml、0.1%-0.75%g/ml或0.75%~1%g/ml。在一个优选的实施方案中,在步骤1中,所述第一修饰物与酸性介质的质量/体积比为0.5%-5%g/ml,例如0.5%~1%g/ml、0.5%~2%g/ml、1%~3%g/ml或3%~5%g/ml。在一个优选的实施方案中,在步骤1中,所述稳定剂与酸性介质的质量/体积比为0.05%~5%g/ml,例如0.5%~1%g/ml、0.5%~2%g/ml、1%~3%g/ml或3%~5%g/ml。在一个优选的实施方案中,在步骤1中,所述稳定剂选自环糊精(例如Dex70)、聚乙烯吡咯烷酮(例如PVP-K30)和泊洛沙姆(例如泊洛沙姆F68)。在一个优选的实施方案中,所述酸性介质为盐酸溶液;优选地,所述盐酸溶液的pH为1.0~3.0。在一个优选的实施方案中,所述聚合反应在室温下进行。在一个优选的实施方案中,步骤1的聚合反应进行1~10小时、例如1~5小时、2~6小时、3~7小时、4~8小时或5~10小时。在一个优选的实施方案中,所述药物与氰基丙烯酸酯单体的质量比为1~20:1、例如1~5:1、3~10:1、5~15:1或15~20:1。在一个优选的实施方案中,步骤2中在加入药物之后,聚合反应进行0.5~5小时,例如0.5~1小时、1~2小时、2~3小时、3~4小时或4~5小时。在一个优选的实施方案中,步骤3中,所述碱为氢氧化钠。在一个优选的实施方案中,步骤3中,使用滤膜进行过滤,优选地,使用孔径为0.45μm的滤膜进行过滤。在一个优选的实施方案中,步骤4中,所述缓冲溶液为磷酸缓冲溶液。在一个优选的实施方案中,在步骤4中,所述第二修饰物与缓冲溶液的质量体积比为0.05%~2%g/ml,例如0.05%~0.1%g/ml、0.1%~0.5%g/ml、0.5%~1%g/ml或1%~2%。在一个优选的实施方案中,步骤4中,孵育的时间为0.5~5小时,例如0.5~1小时、1~2小时、2~3小时、3~4小时或4~5小时。在一个方面,本发明提供了如上所述的纳米粒用于制备载药体系的用途,所述载药体系含有负载了药物的所述纳米粒。在一个优选的实施方案中,所述药物用于诊断、预防和/或治疗受试者的中枢神经系统疾病。在一个优选的实施方案中,所述药物为紫杉醇类药物(例如紫杉醇、多西紫杉醇、卡巴他赛或莱龙泰素,优选为多西紫杉醇)。在一个优选的实施方案中,所述药物为荧光物质(例如香豆素及其衍生物,例如香豆素-6)。在一个优选的实施方案中,所述药物包裹于所述纳米粒中。在一个优选的实施方案中,所述载药体系中,纳米粒对药物的包封率为80%~100%,例如80%~85%、85%~90%、90%~95%或95%~100%。在一个优选的实施方案中,所述载药体系的载药量为1%~10%,例如1%~3%、3%~5%、5%~7%或7%~10%。在一个方面,本发明提供了一种药物组合物,其含有如上所述的载药体系。优选地,药物组合物用于诊断、预防和/或治疗受试者的中枢神经系统疾病。在一个方面,本发明提供了如上所述的纳米粒或载药体系在制备药物组合物中的用途,所述药物组合物用于诊断、预防和/或治疗受试者的中枢神经系统疾病。本发明中,任选地,所述药物组合物还包含药学上可接受的辅料(例如载体和/或赋形剂)。优选地,所述载体和/或赋形剂选自:离子交换剂,氧化铝,硬脂酸铝,卵磷脂,血清蛋白(例如人血清蛋白),甘油,山梨酸,山梨酸钾,饱和植物脂肪酸的部分甘油酯混合物,水,硫酸鱼精蛋白,磷酸氢二钠,磷酸氢钾,氯化钠,锌盐,胶态氧化硅,三硅酸镁,聚乙烯吡咯烷酮,纤维素物质,聚乙二醇,羧甲基纤维素钠,聚丙烯酸酯,蜂蜡,聚乙烯-聚氧丙烯嵌段聚合物和羊毛脂。本发明中,所述药物组合物可以制成药学上可接受的任一剂型。例如,本发明的药物组合物可以配制为片剂、胶囊剂、丸剂、颗粒剂、溶液剂、混悬剂、糖浆剂、注射剂(包括液体注射剂、注射用粉剂或注射用片剂)、栓剂、吸入剂或喷雾剂。此外,本发明的所述药物组合物还可以以任何合适的给药方式,例如口服、胃肠外、直肠、经肺或局部给药等方式施用于受试者。在某些优选的实施方案中,所述药物组合物适用于口服、胃肠外(静脉内、肌肉或皮下),经皮、经舌或呼吸给药。当用于口服给药时,所述药物组合物可制成口服制剂,例如口服固体制剂,如片剂、胶囊剂、丸剂、颗粒剂等;或,口服液体制剂,如口服溶液剂、口服混悬剂、糖浆剂等。当制成口服制剂时,所述药物组合物还可包含适宜的填充剂、粘合剂、崩解剂、润滑剂等。当用于肠胃外给药时,所述药物组合物可制成注射剂,包括包括液体注射剂、注射用粉剂或注射用片剂。当制成注射剂时,所述药物组合物可采用现有制药领域中的常规方法来进行生产。当配制注射剂时,所述药物组合物中可以不加入附加剂,也可根据药物的性质加入适宜的附加剂。当用于直肠给药时,所述药物组合物可制成栓剂等。用于经肺给药时,所述药物组合物可制成吸入剂或喷雾剂等。在某些优选的实施方案中,本发明的纳米粒或载药体系以单位剂量的形式存在于药物组合物或药物中。在某些优选的实施方案中,给予受试者有效量的所述药物组合物。如本文中所使用的,术语“有效量”是指足以获得或至少部分获得期望的效果的量。例如,预防疾病(例如中枢神经系统疾病)有效量是指,足以预防,阻止,或延迟疾病(例如中枢神经系统疾病)的发生的量;治疗疾病有效量是指,足以治愈或至少部分阻止已患有疾病的患者的疾病和其并发症的量。测定这样的有效量完全在本领域技术人员的能力范围之内。例如,对于治疗用途有效的量将取决于待治疗的疾病的严重度、患者自己的免疫系统的总体状态、患者的一般情况例如年龄,体重和性别,药物的施用方式,以及同时施用的其他治疗等等。在一个方面,本发明提供了一种诊断、预防和/或治疗受试者的中枢神经系统疾病的方法,包括给受试者施用如上所述的载药体系或药物组合物。在一个方面,本发明提供了一种提高药物透过受试者血脑屏障的能力的方法,包括使用如上所述的纳米粒负载药物。优选地,所述药物用于诊断、预防和/或治疗受试者的中枢神经系统疾病。在一个方面,本发明提供了一种促进药物透过受试者血脑屏障的方法,包括使用如上所述的纳米粒负载药物,并将药物施用于受试者体内。优选地,所述药物用于诊断、预防和/或治疗受试者的中枢神经系统疾病。例如,本发明实施例中,使用双重修饰的纳米粒负载药物,可以提高药物透过大鼠血脑屏障的能力,使药物在大鼠脑组织中的含量得到提高。在一个方面,本发明提供了如上所述的纳米粒的用途,所述纳米粒用于提高药物透过受试者血脑屏障的能力。优选地,所述药物用于诊断、预防和/或治疗受试者的中枢神经系统疾病。在一个方面,本发明提供了如上所述的纳米粒的用途,所述纳米粒用于促进药物透过受试者的血脑屏障。优选地,所述药物用于诊断、预防和/或治疗受试者的中枢神经系统疾病。在一个方面,本发明提供了如上所述的纳米粒,所述纳米粒用于提高药物透过受试者血脑屏障的能力。优选地,所述药物用于诊断、预防和/或治疗受试者的中枢神经系统疾病。在一个方面,本发明提供了如上所述的纳米粒,所述纳米粒用于促进药物透过受试者的血脑屏障。优选地,所述药物用于诊断、预防和/或治疗受试者的中枢神经系统疾病。在一个方面,本发明提供了如上所述的载药体系,所述载药体系用于诊断、预防和/或治疗受试者的中枢神经系统疾病。本发明中,优选地,所述中枢神经系统疾病选自脑肿瘤、脑卒中、癫痫、阿尔茨海默病、帕金森病、亨廷顿病、肌萎缩侧索硬化症、脱髓鞘病、多发性硬化、精神分裂症、抑郁症和中枢神经损伤。本发明中,优选地,所述受试者为哺乳动物;例如牛科动物、马科动物、羊科动物、猪科动物、犬科动物、猫科动物、啮齿类动物、灵长类动物;例如,人。有益效果本发明提供的双重修饰的PBCA纳米粒,相比于使用吐温-80等表面活性剂修饰的PBCA纳米粒,更加安全有效。本发明的纳米粒可以透过BBB到达脑部,具有明显的血脑屏障通透性并在脑组织内有效富集。将药物负载在本发明的纳米粒中,可以有效提高药物的脑内浓度和脑靶向性,并使药物具有良好的缓释性,可以在体内长效、稳定地释放。本发明的纳米粒和载药体系可以提高药物的BBB通透性,促进药物进入脑部,从而更有利于中枢神经系统疾病的诊断、预防和/或治疗。下面将结合附图和实施例对本发明的实施方案进行详细描述,但是,本领域技术人员将理解,下列附图和实施例仅用于说明本发明,而不是对本发明的范围的限定。根据附图和优选实施方案的下列详细描述,本发明的各种目的和有利方面对于本领域技术人员来说将变得显然。
附图说明
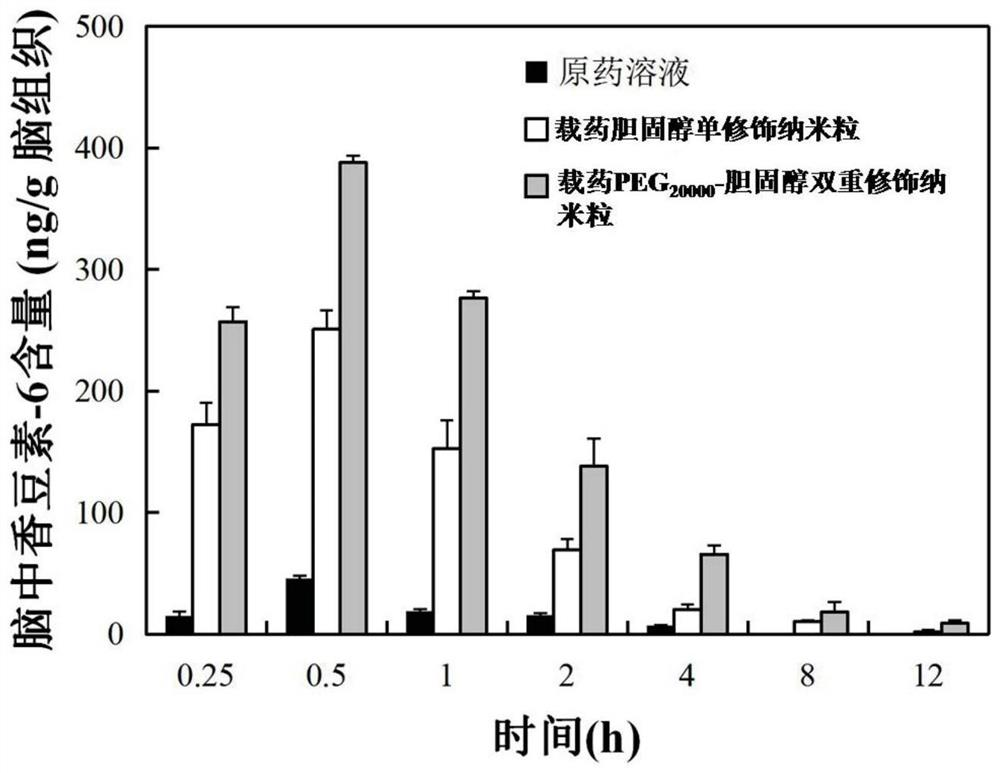
图1为实施例1中,负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒的粒径测量结果(A)和Zeta电位测量结果(B),由图中可以看出,所述纳米粒具有窄的粒径分布,平均粒径为185.4nm,Zeta电位为-0.66mV。图2为实施例2中,负载香豆素-6的胆固醇单修饰PBCA纳米粒(图2(A))及负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒(图2(B))的TEM图。由图中可以看出,胆固醇单修饰PBCA纳米粒及PEG20000-胆固醇双重修饰PBCA纳米粒,纳米粒大小均匀,粒径在200nm左右,而且分散性较好,没有大规模团聚现象,同时两种纳米粒形貌差异不大,说明PEG20000-胆固醇双重修饰对于纳米粒的形态影响不大。图3为实施例2中,负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒的结构表征结果。其中,图3(A)-3(C)分别为mPEG20000、胆固醇和香豆素-6的DSC谱图。由图中可以看出,mPEG20000、胆固醇和香豆素-6的熔融峰分别位于68.21℃、149.98℃和208.29℃。图3(D)为负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒的DSC图谱。图中,mPEG20000和胆固醇的熔融峰依然存在,说明PEG20000和胆固醇没有进入纳米粒内部,而是修饰于纳米粒表面;香豆素-6的熔融峰消失,说明香豆素-6被包裹在纳米粒内部。图4(A)比较了实施例4中,负载香豆素-6的普通纳米粒、负载香豆素-6的胆固醇单修饰纳米粒和负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒的体外释放曲线(n=6,n为平行测试的次数,以下n的含义相同)。如图所示,与普通纳米粒和胆固醇单修饰纳米粒相比,PEG20000-胆固醇双重修饰的纳米粒具有明显的缓释性和改善的释放稳定性。图4(B)比较了实施例4中,负载香豆素-6的普通纳米粒、负载香豆素-6的PEG20000单修饰纳米粒和负载香豆素-6的PEG20000-胆固醇双重修饰纳米粒的体外释放曲线(n=6)。如图所示,与未经修饰的纳米粒及PEG20000单修饰纳米粒相比,PEG20000-胆固醇双重修饰纳米粒具有更显著的缓释特性。图5为实施例5中,香豆素-6溶液(原药)、负载香豆素-6的胆固醇单修饰纳米粒和负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒的血药浓度-时间曲线(n=6)。如图所示,PEG20000-胆固醇双重修饰PBCA纳米粒在体内能够持续释放12小时,与原药溶液和胆固醇单修饰纳米粒相比,具有更长的释放时间,并且同一时间内具有更高的血药浓度。图6(A)为实施例6中,大鼠在分别静脉注射香豆素-6溶液(原药)、负载香豆素-6的胆固醇单修饰纳米粒和负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒后,不同时间点的脑组织中香豆素-6的含量(n=3)。图中,PEG20000-胆固醇双重修饰纳米粒相对于原药溶液和胆固醇单修饰纳米粒,P均小于0.01。如图所示,负载香豆素-6的PEG20000-胆固醇双重修饰纳米粒可以使大鼠脑组织中的香豆素-6的含量明显提高,明显高于注射香豆素-6溶液(原药)和负载香豆素-6的胆固醇单修饰纳米粒,并且具有缓慢释放的过程。图6(B)为实施例6中,注射了不同样品的大鼠脑组织中的香豆素-6的含量,从左到右依次为注射原药溶液、注射普通纳米粒、注射PEG20000单修饰PBCA纳米粒和注射PEG20000-胆固醇双重修饰PBCA纳米粒的大鼠的脑组织中的香豆素-6的含量。图中,**:p<0.05VS原药溶液组;##:p<0.05VS普通纳米粒组;&&:p<0.05VS PEG单修饰纳米粒组。如图所示,PEG20000单修饰PBCA纳米粒与原药溶液及普通PBCA纳米粒相比,脑组织中的香豆素-6的含量显著增高(P<0.01)。而本发明的PEG20000-胆固醇双重修饰PBCA纳米粒可以使脑组织中的香豆素-6的含量相比PEG20000单修饰PBCA纳米粒显著增高(P<0.01)。结果表明,PEG20000-胆固醇双重修饰PBCA纳米粒具有良好的BBB透过性,可以显著促进药物通过血脑屏障。图7显示了实施例7中,不同时间点各组大鼠组织中香豆素-6的浓度。由图中可以看出,相比于胆固醇单修饰纳米粒,PEG20000-胆固醇双重修饰纳米粒在各组织脏器中没有显著的蓄积,并且在肝、脾中的含量明显低于单修饰纳米粒。上述结果说明,负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒体内安全性更好。图8显示了实施例8中,分别给予(A)胆固醇、(B)PEG20000、(C)PBCA、(D)空白PEG20000-胆固醇双重修饰PBCA纳米粒、(E)负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒后,bEnd.3细胞的细胞存活率,图中,横坐标轴为给药浓度,纵坐标轴为细胞存活率。如图所示,胆固醇、PEG20000、PBCA、空白纳米粒以及载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒在实验浓度范围内对bEnd.3细胞均无明显的细胞毒性(细胞存活率>80%)。上述结果说明,空白载体及PEG20000-胆固醇双重修饰PBCA纳米粒体外安全性良好。图9为实施例9中,分别静脉给予大鼠多西紫杉醇原药溶液和负载多西紫杉醇的PEG20000-胆固醇双重修饰PBCA纳米粒后,血药浓度-时间曲线(n=6),如图所示,负载多西紫杉醇的PEG20000-胆固醇双重修饰PBCA纳米粒在体内具有更长的释放时间和更高的血药浓度。图10为实施例10中,分别静脉给予大鼠多西紫杉醇溶液(原药)和负载多西紫杉醇的PEG20000-胆固醇双重修饰PBCA纳米粒后,大鼠脑组织中多西紫杉醇的含量(n=3)。如图所示,多西紫杉醇原药基本不能透过血脑屏障,在脑中未能检出;而负载多西紫杉醇的PEG20000-胆固醇双重修饰PBCA纳米粒可以透过血脑屏障,并且可以使药物在脑中缓慢释放。图11为实施例11中,分别给予多西紫杉醇(原药)和负载多西紫杉醇的PEG20000-胆固醇双重修饰PBCA纳米粒后,小鼠乳腺癌4T1细胞的细胞存活率,图中,横坐标轴为给药浓度(以多西紫杉醇的浓度计量),纵坐标轴为细胞存活率;n=5;PEG20000-胆固醇双重修饰纳米粒相对于原药溶液,P小于0.01。图(A)和图(B)分别为给药后培养24小时和48小时后的结果。如图所示,与多西紫杉醇原药相比,在给药浓度和培养时间相同的情况下,负载多西紫杉醇的PEG20000-胆固醇双重修饰纳米粒对肿瘤细胞的增值具有更强的抑制作用,并且显示出一定的剂量依赖性和时间依赖性。图12为实施例13中,负载香豆素-6的PEG20000-亮氨酸双重修饰PBCA纳米粒,以及负载香豆素-6的未经修饰的PBCA纳米粒的体外释放曲线(n=6)。如图所示,与未经修饰的纳米粒相比,PEG20000-亮氨酸双重修饰纳米粒具有更显著的缓释特性。图13为实施例15中,负载香豆素-6的PEG20000-天冬氨酸双重修饰PBCA纳米粒,以及负载香豆素-6的未经修饰的PBCA纳米粒的体外释放曲线(n=6)。如图所示,与未经修饰的纳米粒相比,PEG20000-天冬氨酸双重修饰纳米粒具有更显著的缓释特性。图14为实施例17中,负载香豆素-6的PEG20000-卵磷脂双重修饰PBCA纳米粒,以及负载香豆素-6的未经修饰的PBCA纳米粒的体外释放曲线(n=6)。如图所示,与未经修饰的纳米粒相比,PEG20000-卵磷脂双重修饰纳米粒具有更显著的缓释特性。图15为实施例18中,注射了不同样品的大鼠脑组织中的香豆素-6的含量,从左到右依次为注射原药溶液、注射普通纳米粒、注射PEG20000-亮氨酸双重修饰PBCA纳米粒、注射PEG20000-天冬氨酸双重修饰PBCA纳米粒和注射PEG20000-卵磷脂双重修饰PBCA纳米粒的大鼠的脑组织中的香豆素-6的含量。三种双重修饰纳米粒相对于原药溶液和普通纳米粒,P均小于0.01。如图所示,与原药溶液及普通PBCA纳米粒相比,本发明的上述三种双重修饰纳米粒可以使脑组织中的香豆素-6的含量显著增高,增加药物的BBB通透性。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。实施例1.负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒的制备及评价(1)负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒的制备方法:将稳定剂Dex70(1%,w/v)与数均分子质量为20000的甲氧基聚乙二醇(mPEG20000)(1.5%,w/v)溶于pH 1.0的盐酸介质中,在室温和磁力搅拌的条件下逐滴缓慢加入BCA单体(1%,v/v),以500rpm的转速搅拌4h后,加入香豆素-6(1%,w/v),以750rpm的转速搅拌2.5h,之后用NaOH中和体系pH至6-7,继续搅拌l h使得BCA单体充分聚合,即得PEG-PBCA纳米粒。得到的PEG-PBCA纳米粒通过0.45μm滤膜过滤后,冷冻干燥,之后复溶于PBS,混匀30min。加入胆固醇(l%,w/v),孵育0.5h,过滤,以20000rpm的速率离心30min,去除上清液,用适量双蒸水重悬沉淀后,冷冻干燥,即得负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒,将其保存在干燥器中。负载香豆素-6的PEG20000单修饰PBCA纳米粒的制备方法:将稳定剂Dex70(1%,w/v)与mPEG20000(1.5%,w/v)溶于pH1.0的盐酸介质中,然后在室温、磁力搅拌下逐滴缓慢加入BCA单体(1%,v/v),以500rpm的转速搅拌4h后,加入香豆素-6(1%,w/v),以750rpm的转速搅拌2.5h,之后用NaOH中和体系pH至6-7,继续搅拌l h使得BCA单体充分聚合,即得负载香豆素-6的PEG20000单修饰PBCA纳米粒。得到的纳米粒通过0.45μm滤膜过滤后,冷冻干燥,将其保存在干燥器中,用作对照实验。按照上述方法制备包含香豆素-6的、未经修饰的PBCA普通纳米粒,以及负载香豆素-6的、胆固醇单修饰纳米粒,作为对照。(2)粒径和电位的测定及结果:将负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒用去离子水稀释至适当浓度,超声30min,使溶液充分混匀,经0.45μm微孔滤膜过滤,取滤液于25℃下测定粒径和电位,结果见图1。图1(A)为纳米粒的粒径测量结果,图1(B)为纳米粒的Zeta电位测量结果。由图中可以看出,负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒具有窄的粒径分布,平均粒径为185.4nm,PDI为0.133,Zeta电位为-0.66mV。按照上述方法测定负载香豆素-6的PEG20000单修饰PBCA纳米粒的粒径和Zeta电位,其平均粒径为194.3nm,PDI为0.159,Zeta电位为-8.04mV。(3)包封率及载药量的测定及结果:取负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒混悬液200μl于Vivaspin超滤离心管(MWCO:2000,德国Sartorius公司),以4000rpm的速率离心20min,将未包裹入进纳米粒的游离药物分离至超滤离心管下层,取下层溶液,使用荧光/化学发光分析仪测定香豆素-6的浓度,计算包封率。取负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒混悬液20μl,加入1980μl乙腈,震荡30s,破坏纳米粒结构,使药物释放出来,使用荧光/化学发光分析仪测定香豆素-6的浓度,计算载药量。结果:负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒包封率为97.8%,载药量为2.07%。按照上述方法测定负载香豆素-6的PEG20000单修饰PBCA纳米粒的包封率及载药量,分别为98.6%和2.03%实施例2.负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒的形貌和结构表征(1)形貌表征方法:采用透射电镜(transmission electron microscope,TEM)对负载香豆素-6的胆固醇单修饰PBCA纳米粒及负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒进行形貌表征。称取一定量冷冻干燥后的纳米粒,用纯水稀释至纳米粒浓度0.5mg/ml,振摇100次充分摇匀,吸取5μl滴在铜网Formvar膜上,至快干时滴加1滴1%(w/v)的磷钨酸水溶液,染色2min,小心吸去大量液体,剩一层液膜,待液膜完全干燥后,用TEM观察。结果:上述两个样品的TEM图见图2。图2(A)和(B)分别为负载香豆素-6的胆固醇单修饰PBCA纳米粒及负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒的TEM图。由图中可以看出,胆固醇单修饰PBCA纳米粒及PEG20000-胆固醇双重修饰PBCA纳米粒,纳米粒大小均匀,粒径在200nm左右,而且分散性较好,没有大规模团聚现象,同时两种纳米粒形貌差异不大,说明PEG20000-胆固醇双重修饰对于纳米粒的形态影响不大。(2)结构表征方法:采用差示扫描量热法(Differential Scanning Calorimetry,DSC)对负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒进行结构表征。分别称取香豆素-6、mPEG20000、胆固醇和负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒各约5mg置于T zero铝盘(美国Waters公司),加密封盖,参比盘为空白T zero铝盘,降温至0℃,在0℃等温5min后以10℃/min的速率升温。结果:上述四个样品的DSC谱图见图3。图3(A)-(C)分别为mPEG20000、胆固醇和香豆素-6的DSC谱图。由图中可以看出,mPEG20000、胆固醇和香豆素-6的熔融峰分别位于68.21℃、149.98℃和208.29℃。图3(D)为负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒的DSC图谱。图中,mPEG20000和胆固醇的熔融峰依然存在,说明PEG20000和胆固醇没有进入纳米粒内部,而是修饰于纳米粒表面;香豆素-6的熔融峰消失,说明香豆素-6被包裹在纳米粒内部。此外,从图中可以看出,聚氰基丙烯酸正丁酯从约300℃开始发生交联,316.45℃处有一明显的吸热峰。实施例3测量负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒表面的胆固醇的浓度(1)方法:使用胆固醇定量试剂盒(Sigma-Aldrich,St.Louis,MO,USA))测量纳米粒表面的胆固醇的质量。纳米粒的平均个数(N)由下式计算得到(Olivier et al.,2002): 其中,W为纳米粒的质量,D为通过纳米粒的平均粒径算得的纳米粒的个数,ρ为密度,即单位体积的纳米粒的质量,为1.1g/cm3。按照下式计算纳米粒表面的胆固醇浓度:纳米粒表面的胆固醇浓度=纳米粒表面的胆固醇的质量/纳米粒的平均个数。(2)结果:计算得到负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒表面的胆固醇的浓度为(8.5±0.4)×10-7ng/纳米粒。实施例4.负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒的体外释放研究(1)方法:取负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒混悬液1ml,置于透析袋(MWCO:20000,USA)内,将透析袋放入200ml pH7.4的磷酸盐缓冲液(PBS)中,37℃恒温水浴及避光条件下,以100rpm的转速搅拌,分别于不同时间点吸取200μl释放液并补液。将取出的释放介质以空白PBS作为对照,采用荧光/化学发光分析仪测定香豆素-6的浓度,每个时间点取6份样品平行测量。以相同的方法测量负载香豆素-6的普通纳米粒、胆固醇单修饰纳米粒和PEG20000单修饰PBCA纳米粒的体外释放曲线,作为对照。(2)结果:各组样品的释放曲线见图4(A)和4(B)。图4(A)比较了负载香豆素-6的普通纳米粒、胆固醇单修饰纳米粒和PEG20000-胆固醇双重修饰纳米粒的体外释放行为。由图中可以看出,与普通纳米粒相比,PEG20000-胆固醇双重修饰纳米粒的体外释放行为具有显著差异(f2=25.89,<50)(f2方程为评价两种制剂的释放度行为的常用标准,其公式为:
其中,Rt为参比样品t时的释放度;Tt为试验样品t时的释放度;n为取样点的个数。FDA规定,f2值在50~100之间,即可以认为两种制剂在同一释药条件中的释药行为没有差别,f2小于50,则认为两者具有显著差异。)普通纳米粒在24小时内即释放完毕,并且在短时间内呈现较高的释放度。PEG20000-胆固醇双重修饰纳米粒的释放时间在48小时以上,并且在短时间内没有突释现象,一方面表明香豆素-6基本都包封在双重修饰纳米粒内部,另一方面表明双重修饰纳米粒具有显著的缓释特性。与胆固醇单修饰纳米粒相比,PEG20000-胆固醇双重修饰纳米粒在相同时间内的释放度较低,说明其在体外具有更加稳定的释放行为。上述结果表明,与未经修饰的普通纳米粒或胆固醇单修饰纳米粒相比,PEG20000-胆固醇双重修饰的纳米粒在体外具有明显的缓释性和更好的释放稳定性。图4(B)比较了负载香豆素-6的普通纳米粒、PEG20000单修饰纳米粒和PEG20000-胆固醇双重修饰纳米粒的体外释放行为。由图中可以看出,PEG20000单修饰纳米粒的体外释放行为与普通纳米粒相比具有显著差异(f2=29.69,<50),与PEG20000-胆固醇双重修饰纳米粒相比没有显著差异(f2=73.93,>50),但12小时后,双重修饰纳米粒具有更好的体外缓释特性。上述结果表明,与未经修饰的纳米粒及PEG20000单修饰纳米粒相比,PEG20000-胆固醇双重修饰纳米粒具有更显著的缓释特性。实施例5.负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒的药代动力学研究(1)实验目的:研究负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒在动物体内的缓释性。(2)方法:取6-8周龄的雄性Wistar大鼠,随机分为3组,每组6只,腹腔注射戊巴比妥溶液(40mg/kg)麻醉,进行颈静脉插管手术,手术恢复至少12h后,分别通过尾静脉注射给予等摩尔量的香豆素-6溶液(原药)、实施例1制备的负载香豆素-6的胆固醇单修饰纳米粒和PEG20000-胆固醇双重修饰PBCA纳米粒。于给药后的不同时间点(5min、15min、30min、45min、1h、2h、4h、8h、12h)于颈静脉插管处取血200μl,处理后测定血液中香豆素-6的含量。(3)结果:图5显示了各组样品的血药浓度-时间曲线。图中,纵坐标为血液中香豆素-6的浓度,横坐标为时间。由图中可以看出,大鼠静脉给药后,不同样品的血药浓度-时间曲线有明显差异。原药溶液给药后仅4h内能够在血液中检测到药物,释放时间最短,没有缓释效果;胆固醇单修饰纳米粒给药后的释放时间与原药溶液相比较长,为8h;PEG20000-胆固醇双重修饰PBCA纳米粒(CLS-PEG NPs)在体内能够持续释放12小时,与原药溶液和胆固醇单修饰纳米粒(CLS NPs)相比,具有更长的释放时间,并且同一时间内具有更高的血药浓度。各药代动力学参数见表1。表1
*p<0.05,**p<0.01vs.游离药物组上述结果表明,与原药溶液和胆固醇单修饰纳米粒相比,PEG20000-胆固醇双重修饰纳米粒在动物体内具有显著更长的释放时间和更高的血药浓度,具有更好的释放行为,并且具有较高的生物利用度。实施例6.负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒的脑组织分布研究研究目的:研究PEG20000-胆固醇双重修饰PBCA纳米粒在动物体内的脑靶向性。实验1(1)方法:取6-8周龄的雄性Wistar大鼠,随机分为3组,每组21只,分别通过尾静脉注射给予等摩尔量的香豆素-6溶液(原药)、实施例1制备的负载香豆素-6的胆固醇单修饰纳米粒和PEG20000-胆固醇双重修饰PBCA纳米粒。分别在给药后不同时间点(15min、30min、1h、2h、4h、8h、12h)处死大鼠,取脑组织,测定脑内香豆素-6的含量。(2)结果:图6(A)显示了不同时间点各组大鼠脑组织中香豆素-6的浓度。由图中可以看出,注射了原药溶液的大鼠的脑组织中的香豆素-6的含量很低,均不超过50ng/g脑组织,且在给药8h后,脑组织中检测不到香豆素-6,这说明香豆素-6原药的BBB透过性较低,且不具有缓释性。注射了负载香豆素-6的胆固醇单修饰纳米粒的大鼠,其脑组织中的香豆素-6的含量明显高于注射了香豆素-6原药的大鼠,但在8小时后,检测不到脑中的香豆素-6。注射了负载香豆素-6的PEG20000-胆固醇双重修饰纳米粒的大鼠,其脑组织中香豆素-6的含量比注射胆固醇单修饰纳米粒的大鼠有了进一步的提高,且在12小时后仍能脑中检出香豆素-6。上述结果表明,与香豆素-6原药和负载香豆素-6的胆固醇单修饰纳米粒相比,负载香豆素-6的PEG20000-胆固醇双重修饰纳米粒具有良好的BBB透过性,可以明显促进药物通过血脑屏障,并且具有缓慢释放的过程。实验2(1)方法:取6-8周龄的雄性Wistar大鼠,随机分为4组,每组3只,分别尾静脉注射给予等摩尔量的香豆素-6溶液(原药)、负载香豆素-6的普通纳米粒、负载香豆素-6的PEG20000单修饰PBCA纳米粒和负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒。分别在给药后30min处死大鼠,取脑组织,测定脑内香豆素-6的含量。(2)结果:图6(B)显示了大鼠脑组织中的香豆素-6的含量,从左到右依次为注射原药溶液、注射普通纳米粒、注射PEG20000单修饰PBCA纳米粒和注射PEG20000-胆固醇双重修饰PBCA纳米粒的大鼠的脑组织中的香豆素-6的含量。如图所示,PEG20000单修饰PBCA纳米粒与原药溶液及普通PBCA纳米粒相比,脑组织中的香豆素-6的含量显著增高(P<0.01)。而本发明的PEG20000-胆固醇双重修饰PBCA纳米粒可以使脑组织中的香豆素-6的含量相比PEG20000单修饰PBCA纳米粒显著增高(P<0.01)。结果表明,与香豆素-6原药和负载香豆素-6的PEG20000单修饰纳米粒相比,负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒具有良好的BBB透过性,可以显著促进药物通过血脑屏障。实施例7.负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒的组织分布研究(1)实验目的:研究PEG20000-胆固醇双重修饰PBCA纳米粒在动物体内的组织分布情况,考察其体内毒性。(2)方法:取6-8周龄的雄性Wistar大鼠,随机分为3组,每组21只,分别通过尾静脉注射给予等摩尔量的香豆素-6溶液(原药)、实施例1制备的负载香豆素-6的胆固醇单修饰纳米粒和PEG20000-胆固醇双重修饰PBCA纳米粒。分别在给药后不同时间点(15min、30min、1h、2h、4h、8h、12h)处死大鼠,取心、肝、脾、肺、肾组织,测定其中的香豆素-6含量。(3)结果:图7显示了不同时间点各组大鼠组织中香豆素-6的浓度。由图中可以看出,相比于胆固醇单修饰纳米粒,PEG20000-胆固醇双重修饰纳米粒在各组织脏器中没有显著的蓄积,并且在肝、脾中的含量明显低于单修饰纳米粒。上述结果说明,负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒体内安全性更好。实施例8.负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒的体外安全性考察(1)实验目的:考察PEG20000-胆固醇双重修饰PBCA纳米粒的细胞毒性(2)实验方法:采用MTT法检测细胞的存活率。具体步骤为:将处于对数生长期的bEnd.3细胞(小鼠脑微血管内皮细胞),消化计数后以5×104/孔的密度接种于96孔培养板中。在5%CO2、37℃培养箱中培养24h后,吸弃旧培养基,分别加入含系列浓度(5、10、20、50、100、200、500和1000μg/ml)的胆固醇、PEG20000和PBCA,以及含系列浓度(1、2、5、10、20、50、100和200μg/ml)的空白PEG20000-胆固醇双重修饰PBCA纳米粒和负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒的培养基各200μL,分别继续培养24h和48h后,吸弃旧培养基,每孔分别加入含0.5mg/ml的MTT的培养基。继续培养4h后,吸弃培养液,PBS润洗两遍,加入200μl DMSO溶解甲臢结晶,避光振摇10min;然后用酶标仪测定各孔在490nm处的OD值。以未加药物的培养细胞的OD值作为对照(100%),计算各给药组的细胞存活率,以考察细胞的存活情况,每组设置5个重复孔。(3)实验结果:图8显示了分别给予(A)胆固醇、(B)PEG20000、(C)PBCA、(D)空白PEG20000-胆固醇双重修饰PBCA纳米粒、(E)负载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒后,bEnd.3细胞的细胞存活率,图中,横坐标轴为给药浓度,纵坐标轴为细胞存活率。如图所示,胆固醇、PEG20000、PBCA、空白纳米粒以及载香豆素-6的PEG20000-胆固醇双重修饰PBCA纳米粒在实验浓度范围内对bEnd.3细胞均无明显的细胞毒性(细胞存活率>80%)。上述结果说明,空白载体及PEG20000-胆固醇双重修饰PBCA纳米粒体外安全性良好。实施例9.负载多西紫杉醇的PEG20000-胆固醇双重修饰PBCA纳米粒的药代动力学研究(1)实验目的:多西紫杉醇为治疗乳腺癌和非小细胞肺癌的药品,但是其临床上多为静脉滴注给药,不易透过血脑屏障。本实验的目的是以多西紫杉醇为例,将不易透过血脑屏障的药物负载到本发明的PEG20000-胆固醇双重修饰PBCA纳米粒中,观察其静脉注射后的缓释情况。(2)方法:按照实施例1的方法制备负载多西紫杉醇的PEG20000-胆固醇双重修饰PBCA纳米粒,并对其进行表征。负载多西紫杉醇的PEG20000-胆固醇双重修饰PBCA纳米粒具有窄的粒径分布,平均粒径为200.7nm,PDI为0.122,Zeta电位为-2.11mV;包封率为98.8%,载药量为2.13%。取6-8周龄的雄性Wistar大鼠进行颈静脉插管手术,手术恢复至少12h后,将大鼠随机分为2组,每组6只,分别尾静脉注射给予多西紫杉醇溶液(原药)和负载多西紫杉醇的PEG20000-胆固醇双重修饰PBCA纳米粒。于给药后不同时间点于颈静脉插管处取血200μl,处理后用HPLC测定血液中多西紫杉醇的含量。(3)结果:图9显示了大鼠静脉给药后,多西紫杉醇原药溶液和负载多西紫杉醇的PEG20000-胆固醇双重修饰PBCA纳米粒的血药浓度-时间曲线,由图中可以看出,两者具有明显差异。负载多西紫杉醇的PEG20000-胆固醇双重修饰PBCA纳米粒在体能可以持续释放8小时,而原药溶液在给药2小时后无法在血液中检测到。并且,负载多西紫杉醇的PEG20000-胆固醇双重修饰PBCA纳米粒在体内具有更高的血药浓度。实施例10.负载多西紫杉醇的PEG20000-胆固醇双重修饰PBCA纳米粒的脑组织分布研究(1)实验目的:本实验的目的是以多西紫杉醇为例,将不易透过BBB的药物负载到本发明的PEG20000-胆固醇双重修饰PBCA纳米粒中,观察其静脉注射后透过BBB进入脑组织的情况。如果多西紫杉醇在脑组织中的浓度增高,则表明本发明的PEG20000-胆固醇双重修饰PBCA纳米粒具有脑靶向性,能够将不易透过BBB的药物载入脑组织。(2)方法:取6-8周龄的雄性Wistar大鼠进行颈静脉插管手术,手术恢复至少12h后,将大鼠随机分为2组,每组6只,分别尾静脉注射给予多西紫杉醇溶液(原药)、以及负载多西紫杉醇的PEG20000-胆固醇双重修饰PBCA纳米粒。分别在给药后不同时间点处死大鼠,取脑组织,用生理盐水洗涤并称重。处理后用HPLC测定脑组织中多西紫杉醇的含量。(3)结果:图10显示了大鼠静脉给药后不同时间,脑组织中多西紫杉醇的含量。如图所示,静脉给药后,多西紫杉醇原药基本不能透过血脑屏障,在脑中未能检出;而负载多西紫杉醇的PEG20000-胆固醇双重修饰PBCA纳米粒可以透过血脑屏障,使脑组织中多西紫杉醇的含量显著增高,且8小时后脑组织中仍能检测出药物。上述结果表明,本发明的PEG20000-胆固醇双重修饰PBCA纳米粒可以促进多西紫杉醇透过血脑屏障,并且可以使药物在脑中缓慢释放。实施例11.负载多西紫杉醇的PEG20000-胆固醇双重修饰PBCA纳米粒的体外抑制肿瘤细胞增殖效果(1)实验目的:本实验的目的是以多西紫杉醇为例,观察药物负载到PEG20000-胆固醇双重修饰PBCA纳米粒后的药效作用。(2)方法:采用MTT法检测肿瘤细胞的增殖情况。具体步骤为:将处于对数生长期的4T1细胞(小鼠乳腺癌细胞),消化计数后以5×104/孔的密度接种于96孔培养板中。在5%CO2、37℃培养箱中培养24h后,吸弃旧培养基,分别加入含系列浓度(0.0001、0.001、0.01、1、10和100nmol/ml)的多西紫杉醇(原药)和负载多西紫杉醇的PEG20000-胆固醇双重修饰PBCA纳米粒(给药浓度按照其负载的多西紫杉醇的量计算)的培养基各200μL,分别继续培养24h和48h后,吸弃旧培养基,每孔分别加入含0.5mg/ml的MTT的培养基。继续培养4h后,吸弃培养液,PBS润洗两遍,加入200μl DMSO溶解甲臢结晶,避光振摇10min;然后用酶标仪测定各孔在490nm处的OD值。以未加药物的培养细胞的OD值作为对照(100%),计算各给药组的细胞存活率,以考察肿瘤细胞的增殖情况,每组设置5个重复孔。(3)结果:图11为分别给予多西紫杉醇(原药)和负载多西紫杉醇的PEG20000-胆固醇双重修饰PBCA纳米粒后,小鼠乳腺癌4T1细胞的细胞存活率,图中,横坐标轴为给药浓度(以多西紫杉醇的浓度计量),纵坐标轴为细胞存活率。图11(A)和图11(B)分别为给药后培养24小时和48小时后的结果。如图所示,浓度为0.0001nmol/ml的负载多西紫杉醇的PEG20000-胆固醇双重修饰纳米粒在给药24小时后即可使肿瘤细胞的存活率降至约90%,而给予多西紫杉醇原药的肿瘤细胞在给药24小时后,细胞存活率无明显变化。与多西紫杉醇原药相比,在给药浓度和培养时间相同的情况下,负载多西紫杉醇的PEG20000-胆固醇双重修饰纳米粒对肿瘤细胞的增值具有更强的抑制作用,并且显示出一定的剂量依赖性和时间依赖性,给药浓度越高,培养时间越长,对肿瘤细胞增值的抑制作用明显。上述结果表明,与多西紫杉醇原药相比,负载多西紫杉醇的PEG20000-胆固醇双重修饰纳米粒可以更好地抑制肿瘤细胞的增殖。相比于原药溶液,药物负载于本发明的双重修饰PBCA纳米粒中,不仅未减低原药的药效,反而具有更好的治疗效果。实施例12.负载香豆素-6的PEG20000-亮氨酸双重修饰PBCA纳米粒的制备及评价(1)制备方法:将稳定剂Dex70(1%,w/v)与mPEG20000(1.5%,w/v)溶于pH1.0的盐酸介质中,然后在室温、磁力搅拌下逐滴缓慢加入BCA单体(1%,v/v),以500rpm的转速搅拌4h后,加入香豆素-6(1%,w/v),以750rpm的转速搅拌2.5h,之后用NaOH中和体系pH至6-7,继续搅拌l h,使得BCA单体充分聚合,即得PEG-PBCA纳米粒。得到的纳米粒通过0.45μm滤膜过滤后,冷冻干燥,之后复溶于PBS,混匀30min。加入亮氨酸(l%,w/v),孵育0.5h,过滤后冷冻干燥,即得负载香豆素-6的PEG20000-亮氨酸双重修饰PBCA纳米粒,将其保存在干燥器中。按照上述方法制备负载香豆素-6的未经修饰的PBCA普通纳米粒作为对照。(2)粒径和电位的测定及结果:按照实施例1的方法测定负载香豆素-6的PEG20000-亮氨酸双重修饰PBCA纳米粒的粒径和Zeta电位,平均粒径为167.3nm,PDI为0.138,Zeta电位为-9.63mV。(3)包封率及载药量的测定及结果:按照实施例1的方法测定香豆素-6的包封率及载药量,分别为98.1%和2.04%。实施例13.负载香豆素-6的PEG20000-亮氨酸双重修饰PBCA纳米粒的体外释放研究(1)方法:取PEG20000-亮氨酸双重修饰PBCA纳米粒1ml,置于透析袋(MWCO:20000,USA)内,将透析袋放入200ml pH7.4磷酸盐缓冲液(PBS)中,37℃恒温水浴、避光条件下,以100rpm的转速搅拌,24小时内分别于不同时间点吸取200μl释放液并补液。将取出的释放介质以空白PBS作为对照,测定香豆素-6的浓度,每个时间点取6份样品平行测量。以相同的方法对负载香豆素-6的未经修饰的PBCA纳米粒进行测定。(2)结果:图12为负载香豆素-6的PEG20000-亮氨酸双重修饰PBCA纳米粒,以及负载香豆素-6的未经修饰的PBCA纳米粒的体外释放曲线。由图中可以看出,PEG20000-亮氨酸双重修饰纳米粒的体外释放行为与普通纳米粒相比具有显著差异(f2=32.88,<50)。与未经修饰的纳米粒相比,PEG20000-亮氨酸双重修饰纳米粒具有更显著的缓释特性,说明其具有更好的稳定性,有利于其在体内有更好的BBB通透性。实施例14.负载香豆素-6的PEG20000-天冬氨酸双重修饰PBCA纳米粒的制备及评价(1)制备方法:将稳定剂Dex70(1%,w/v)与mPEG20000(1.5%,w/v)溶于pH1.0的盐酸介质中,然后室温、磁力搅拌下逐滴缓慢加入BCA单体(1%,v/v),以500rpm的转速搅拌4h后,加入香豆素-6(1%,w/v),以750rpm的转速搅拌2.5h,之后用NaOH中和体系pH至6-7,继续搅拌l h使得BCA单体充分聚合,即得PEG-PBCA纳米粒。得到的纳米粒通过0.45μm滤膜过滤后,冷冻干燥,之后复溶于PBS,混匀30min。加入L-天冬氨酸(l%,w/v),孵育0.5h,过滤后冷冻干燥,即得PEG20000-天冬氨酸双重修饰PBCA纳米粒,将其保存在干燥器中。按照上述方法制备负载香豆素-6的未经修饰的PBCA普通纳米粒,作为对照。(2)粒径和电位的测定及结果:按照实施例1的方法测定负载香豆素-6的PEG20000-天冬氨酸双重修饰PBCA纳米粒的粒径和Zeta电位,平均粒径为146.2nm,PDI为0.119,Zeta电位为-6.78mV。(3)包封率及载药量的测定及结果:按照实施例1的方法测定香豆素-6的包封率及载药量,分别为96.9%和1.98%。实施例15.负载香豆素-6的PEG20000-天冬氨酸双重修饰PBCA纳米粒体外释放研究(1)方法:取负载香豆素-6的PEG20000-天冬氨酸双重修饰PBCA纳米粒1ml,置于透析袋(MWCO:20000,USA)内,将透析袋放入200ml pH7.4磷酸盐缓冲液(PBS)中,37℃恒温水浴中、避光、以100rpm的转速搅拌,24小时内分别于不同时间点吸取200μl释放液并补液。将取出的释放介质以空白PBS作为对照,测定香豆素-6的浓度,每个时间点取6份样品平行测量。以相同的方法对负载香豆素-6的未经修饰的PBCA纳米粒进行测定。(2)结果:图13为负载香豆素-6的PEG20000-天冬氨酸双重修饰PBCA纳米粒,以及负载香豆素-6的未经修饰的PBCA纳米粒的体外释放曲线。由图中可以看出,PEG20000-天冬氨酸双重修饰纳米粒的体外释放行为与普通纳米粒相比具有显著差异(f2=34.32,<50)。与未经修饰的纳米粒相比,PEG20000-天冬氨酸双重修饰纳米粒具有更显著的缓释特性,说明其具有更好的稳定性,有利于其在体内有更好的BBB通透性。实施例16.负载香豆素-6的PEG20000-卵磷脂双重修饰PBCA纳米粒的制备及评价(1)制备方法:将稳定剂Dex70(1%,w/v)与mPEG20000(1.5%,w/v)溶于pH1.0的盐酸介质中,然后在室温、磁力搅拌下逐滴缓慢加入BCA单体(1%,v/v),以500rpm的转速搅拌4h后,加入香豆素-6(1%,w/v),以750rpm的转速搅拌2.5h,之后用NaOH中和体系pH至6-7,继续搅拌l h使得BCA单体充分聚合,即得PEG-PBCA纳米粒。得到的纳米粒通过0.45μm滤膜过滤后,冷冻干燥,之后复溶于PBS,混匀30min。加入卵磷脂(l%,w/v),孵育0.5h,过滤后冷冻干燥,即得负载香豆素-6的PEG20000-卵磷脂双重修饰PBCA纳米粒,将其保存在干燥器中。按照上述方法制备负载香豆素-6的未经修饰的PBCA普通纳米粒,作为对照。(2)粒径和电位的测定及结果:按照实施例1的方法测定负载香豆素-6的PEG20000-卵磷脂双重修饰PBCA纳米粒的粒径和Zeta电位,其平均粒径为344.2nm,PDI为0.252,Zeta电位为-37.3mV。(3)包封率及载药量的测定及结果:按照实施例1的方法测定香豆素-6的包封率及载药量,分别为97.4%和1.95%实施例17.PEG20000-卵磷脂双重修饰PBCA纳米粒的体外释放研究(1)方法:取负载香豆素-6的PEG20000-卵磷脂双重修饰PBCA纳米粒1ml,置于透析袋(MWCO:20000,USA)内,将透析袋放入200ml pH7.4磷酸盐缓冲液(PBS)中,37℃恒温水浴避光以100rpm的转速搅拌,24小时内分别于不同时间点吸取200μl释放液并补液。将取出的释放介质以空白PBS作为对照,测定香豆素-6的浓度,每个时间点取6份样品平行测量。(2)结果:图14为负载香豆素-6的PEG20000-卵磷脂双重修饰PBCA纳米粒,以及负载香豆素-6的未经修饰的PBCA纳米粒的体外释放曲线。由图中可以看出,PEG20000-卵磷脂双重修饰纳米粒的体外释放行为与普通纳米粒相比具有显著差异(f2=30.98,<50)。与未经修饰的纳米粒相比,PEG20000-卵磷脂双重修饰纳米粒具有更显著的缓释特性,说明其具有更好的稳定性,有利于其在体内有更好的BBB通透性。实施例18.具有不同修饰物的双重修饰PBCA纳米粒的脑组织分布研究(1)实验目的:研究具有不同修饰物的双重修饰PBCA纳米粒在动物体内的脑靶向性。(2)方法:取6-8周龄的雄性Wistar大鼠,随机分为5组,每组3只,分别尾静脉注射给予等摩尔量的香豆素-6溶液(原药)、负载香豆素-6的普通纳米粒,负载香豆素-6的PEG20000-亮氨酸双重修饰PBCA纳米粒、负载香豆素-6的PEG20000-天冬氨酸双重修饰PBCA纳米粒和负载香豆素-6的PEG20000-卵磷脂双重修饰PBCA纳米粒。分别在给药后30min处死大鼠,取脑组织,测定脑内香豆素-6的含量。(3)结果:图15显示了大鼠脑组织中的香豆素-6的含量,从左到右依次为注射原药溶液、注射普通纳米粒、注射PEG20000-亮氨酸双重修饰PBCA纳米粒、注射PEG20000-天冬氨酸双重修饰PBCA纳米粒和注射PEG20000-卵磷脂双重修饰PBCA纳米粒的大鼠的脑组织中的香豆素-6的含量。如图所示,与原药溶液及普通PBCA纳米粒相比,本发明的上述三种双重修饰纳米粒可以使脑组织中的香豆素-6的含量显著增高(P<0.01)。结果表明,上述三种双重修饰PBCA纳米粒均具有良好的BBB透过性,可以显著促进药物通过血脑屏障。实施例19.PEG20000-卵磷脂双重修饰PBCA纳米粒的制备将稳定剂Dex70(1%,w/v)与mPEG20000(1.5%,w/v)溶于pH1.0的盐酸介质中,然后在室温、磁力搅拌下逐滴缓慢加入BCA单体(1%,v/v),以500rpm的转速搅拌4h后,用NaOH中和体系pH至6-7,继续搅拌l h使得BCA单体充分聚合,即得PEG-PBCA纳米粒。得到的纳米粒通过0.45μm滤膜过滤后,冷冻干燥,之后复溶于PBS,混匀30min。加入卵磷脂(l%,w/v),孵育0.5h,过滤后冷冻干燥,即得PEG20000-卵磷脂双重修饰PBCA纳米粒,将其保存在干燥器中。从以上各实施例的实验结果可以看出,本发明的双重修饰PBCA纳米粒具有良好的BBB通透性。将不易透过BBB的药物负载到本发明的双重修饰PBCA纳米粒中,能够使药物在动物脑组织中的含量显著增高,并具有更好的缓释行为,有利于提高药物的安全性及药效作用。包含上述载药纳米粒的载药体系,可用于制备脑靶向制剂,在中枢神经系统疾病(包括但不限于脑肿瘤)的诊断、预防和/或治疗中具有良好的应用价值。尽管本发明的具体实施方式已经得到详细的描述,但本领域技术人员将理解:根据已经公开的所有教导,可以对细节进行各种修改和变动,并且这些改变均在本发明的保护范围之内。本发明的全部范围由所附权利要求及其任何等同物给出。



企业营业执照
专利注册证原件
身份证
个体户营业执照
身份证
专利注册证原件
专利代理委托书
转让申请书
转让协议
手续合格通知书
专利证书
专利利登记簿副本





提交